挑战“癌王”
2024-12-11
来源: drugdu
 506
506
 revolution medicines公司近日宣布,其研发的泛ras抑制剂rmc-6236在治疗经过其他治疗的胰腺导管腺癌(pdac)患者中显示出显著的抗肿瘤效果和良好的安全性。
revolution medicines公司近日宣布,其研发的泛ras抑制剂rmc-6236在治疗经过其他治疗的胰腺导管腺癌(pdac)患者中显示出显著的抗肿瘤效果和良好的安全性。
研究结果显示,rmc-6236作为单一药物用于二线治疗,能够提升携带ras突变的pdac患者的中位无进展生存期(pfs)和总生存期(os),其中患者在6个月的总生存率数据令人瞩目:kras g12x突变患者为100%,任意ras突变患者为97%。
泛kras抑制剂一路高歌猛进,挑战“癌王”胰腺癌。
最难对付的靶点?
胰腺癌作为高致死率恶性肿瘤,ras基因突变对胰腺癌的发生发展具有重要影响。数据显示,约85%~95%的胰腺癌患者存在ras突变,尤其是kras突变占主导地位。kras突变不仅常见于胰腺癌,还是结直肠癌等多种胃肠道肿瘤的高频突变。
具体到kras突变类型,约91%胰腺癌患者属于kras g12突变,其中kras g12d约占40%,kras g12v约占三分之一,而kras g12和kras g12c则较为罕见,各约占1%。kras是一类gtp结合蛋白,通过与gtp和gdp结合,在活化和失活状态之间转变,来调节自身活性和下游信号通路的开启和关闭,从而完成信号传导。当癌变时,如g12d基因突变导致下游信号持续激活,促进癌细胞增殖和存活。
然而,kras一度是“不可成药靶点”,由于kras蛋白体积小、表面光滑、几乎没有适合小分子结合的口袋。值得庆幸的是,kras g12c因其结合口袋利于靶向的特点,成为首个被成功靶向的kras突变,这一突破为后续针对其他kras突变的研究奠定了基础。
全球最早获批上市的kras g12c抑制剂分别是安进的索托拉西布(sotorasib)和bms的阿达格拉西布(adagrasib),两者均被指南推荐作为iv期kras g12c突变nsclc患者的后线治疗方案,但是目前两款药都尚未在国内获批。今年以来,陆续有两款国产的kras g12c抑制剂获批上市分别是信达/劲方医药的氟泽雷塞和正大天晴/益方生物的格舒瑞昔。
由于目前全球获批上市的四个kras抑制剂都是kras g12c抑制剂且都尚无胰腺癌适应症,对于其他突变或者野生型的患者并不适用,覆盖人群有限。kras突变胰腺癌仍存在巨大未满足的临床需求,泛kras抑制剂的研究是如今ras抑制剂研究的重要方向,有望将“癌症之王”撕开一道口子。现在,rmc-6236有可能在这个赛道拔得头筹。
备受瞩目的领跑者
revolution medicines成立于2014年10月,是美国特拉华州的一家临床阶段的肿瘤学公司。专注于开发靶向疗法,以抑制ras成瘾性癌症的前沿靶点。该公司拥有先进的基于结构的药物发现能力,其基础是深厚的化学生物学和癌症药理学知识以及创新的专有技术,能够创造适合非常规结合位点的小分子。
revolution的研发管线包括一系列ras(on)抑制剂和ras伴侣抑制剂,旨在抑制ras蛋白的多种致癌变体。该公司的ras(on)抑制剂rmc-6236、rmc-6291和rmc-9805目前正在临床开发中。该公司管线中的其他开发机会集中在ras(on)突变选择性抑制剂上,包括rmc-5127(g12v)、rmc-0708(q61h)和rmc-8839(g13c),以及ras伴侣抑制剂rmc-4630和rmc-5552。
revolution正在开发一系列ras抑制剂。由于这些药物在治疗实体肿瘤,特别是胰腺癌方面的潜力,该公司的股票在过去12个月中翻了一番。
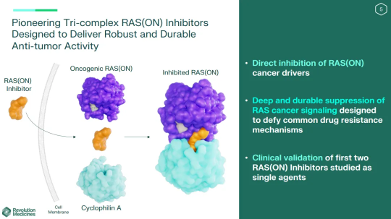
revolution以其独特特色的三元复合物抑制剂平台获得业内瞩目。该平台设计的分子可以与细胞内伴侣蛋白亲环蛋白a结合,产生抑制性二元复合物,该复合物再与活性gtp结合的ras来形成三元复合物,并通过破坏与效应物的相互作用来抑制ras信号传导,达到抑制肿瘤的目的。
“明日之星”rmc-6236正是在此平台产生,相比其他传统kras抑制剂,其主要优势包括:能够同时抑制多种不同的ras突变类型,包括ras g12x、g13x和q61x突变,而不仅仅局限于某一种特定的突变;靶向ras的活性状态,而非传统的非活性状态,从而避免了突变体对抑制剂的耐药性;阻止ras与效应子的结合,并增强其gtpase活性;具有突变特异性,可以根据不同突变体选择合适的分子进行治疗。
此外,revolution管线中另一款备受瞩目的kras g12d抑制剂rmc-9805也在近日传来好消息。在接受1,200毫克每日剂量的kras g12d抑制剂rmc-9805治疗的40名先前治疗过的胰腺癌患者中,有12名患者的肿瘤缩小至少30%,意味着其客观缓解率达30%。
赛道已悄然崛起
kras突变癌症的治疗前景广阔,相关药物市场预计在未来几年会显著增长,根据delveinsight的分析,kras抑制剂的市场规模到2022年将达到2.4亿美元,到2032可达到惊人的100亿美元,年复合增值率36%。
目前已经获批或在临床试验中的kras抑制剂,如sotorasib和adagrasib,都是通过结合kras g12c突变蛋白的“off”状态来发挥作用的。它们可以与gdp结合的开关ii口袋形成共价键,并锁定kras在失活状态。然而,这种策略也存在一些局限性,比如只能针对特定的突变类型、不能完全抑制下游信号通路、容易出现耐药性等。而这可能便是现有kras g12c上市药物销售额不及预期的主要原因。
针对单突变kras的抑制剂受众始终是有限的,这便引起了药企对开发泛kras抑制剂的不懈追求。据不完全统计,目前全球范围内在研的泛kras抑制剂近35款,其中进入临床阶段的有8款。除rmc-6236外还有jab-23e73(加科思,临床i/ii期)、ly4066434(礼来,临床i期)、pf-07934040(临床i期)、bgb-53038(百济神州,临床i期)、qtx3034(quanta,临床i期)、yl-17231(璎黎药业,临床i期)和bi 3706674(勃林格殷格翰,临床i期)。
针对kras靶向疗法,此前国内临床在研管线几乎“清一色”扎堆kras g12c/g12d,泛kras抑制剂的前景广阔,吸引着国内药企也奋起直追。璎黎药业的yl-17231是国内第一个进入临床阶段的泛kras抑制剂,正在中美两地开展i期临床。加思科的泛kras抑制剂jab-23e73近日在中国完成了i/iia期临床试验首例患者给药。jab-23e73可同时抑制活性及非活性状态的kras,对hras、nras无明显抑制,能同时抑制on/off状态的kras。百济神州泛kras抑制剂bgb-53038也在今年9月获批ind。
除了小分子抑制剂,该领域不同形式的药物近期也迎来诸多新进展,比如:来自邓迪大学和bi的科学家团队在science杂志上发表突破成果,研究开发出了一种名为acbi3的小分子protac。acbi3已被证明能够高效且选择性地降解17种最常见的kras突变体中的13种。这些发现阐明了一个新的泛kras降解概念。
此外,针对七种常见kras突变(g12d、g12r、g12v、g12a、g12c、g12s、g13d)的在研抗癌疫苗eli-002 7p 2期临床试验amplify-7p已经完成首位患者给药,用于治疗携带kras突变的胰腺导管腺癌(pdac)辅助治疗。
在nature medicine上的i期临床试验数据突显了eli-002 7p的潜力:在25名实体瘤患者中,84%的患者观察到kras突变体特异性t细胞应答,t细胞应答高于中位数值的患者的疾病进展或死亡风险降低了86%。84%的患者观察到肿瘤生物标志物应答,24%的患者实现生物标志物清除。在中位随访8.5个月后,这25名患者的中位无复发生存期(rfs)为16.33个月。
https://news.yaozh.com/archive/44650.html
责编: editor相关news
- 诺华将两款眼科药物在中国的独家进口、商业推广和分销权转让给康哲药业 2025-11-02
- 2025-11-02
- 昂利康:注射用alk-n001/qhl-1618于2025年4月获得药物临床试验批准通知书 2025-11-01
- 全球首个 乐普生物egfr adc新药mrg003获批上市 2025-11-01
- 智飞生物交出十年来最差三季报 2025-10-31