国产爆红新药,有人开始掉队
2025-01-22
来源: drugdu
 203
203
 2024年下半年,国产tce双抗交易风靡全球,而其中与自免相关交易更是占到了所有7笔国产tce双抗交易中的5笔,堪称“最红”的国产创新药物类型。
2024年下半年,国产tce双抗交易风靡全球,而其中与自免相关交易更是占到了所有7笔国产tce双抗交易中的5笔,堪称“最红”的国产创新药物类型。
正是在这波全球药企疯抢自免tce双抗权益的热潮中,已经有研发者开始掉队,并且还是进度最靠前的海外biotech公司igm biosciences。
1月9日,igm biosciences宣布公司将裁员73%,并停止开发两款自免候选药物imvotamab(cd3/cd20双抗)和igm-2644(cd3/cd38双抗)。igm公司之所以做出这样的决定,其首席执行官mary beth harler表示,imvotamab在治疗类风湿性关节炎和系统性红斑狼疮的ib期研究的中期数据表明,b细胞耗竭的深度和一致性未达到公司预期。
在放弃imvotamab和igm-2644后,igm biosciences目前管线中仅剩一款与赛诺菲合作的igm抗体,彻底退出自免tce赛道的竞争。
这或许给正在狂热开发自免tce双抗的biotech和mnc买家们,泼了一盆冷水。
01
igm biosciences的再一次断臂
这并不是igm公司第一次裁员进行战略调整,其上一次裁员可追溯到2023年底,当时该公司裁员22%并停止所有血液瘤项目以及其靶向细胞因子候选产品的临床开发。
2024年9月,igm公司取消了肿瘤方向的优先级,全面押注自免方向的探索,比如公司核心管线imvotamab过去一开始针对的是惰性nhl、dlbcl及其他癌症适应症,但后续其在nhl中产生的数据不尽如人意。
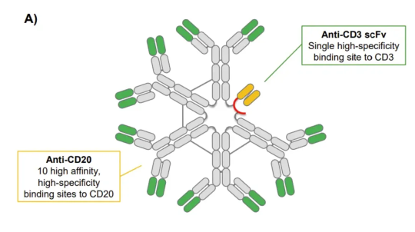
igm公司的技术核心特点是开发igm为骨架的抗体药物,相比于一般最常见的igg抗体(2个结合位点),igm抗体以五聚体形式存在,具有多价性(理论上有12个结合位点),这赋予了其更强结合力和靶点聚集效应。
从结构上看,imvotamab具有多达10个靶向cd20的结合位点,以及1个cd3的结合位点,作用机制是通过t细胞依赖的细胞毒性(tdcc)和补体依赖的细胞毒性(cdc)杀伤b细胞。如此多的cd20结合位点带来的大概率是靶点亲和力的拉满,尽管是cd20极低表达量的逃逸癌细胞,imvotamab都能够结合并杀伤。
临床前小鼠模型数据显示,imvotamab较现有cd20单抗更有效地清除低cd20表达的b细胞,其ec50指标比奥妥珠单抗、利妥昔单抗分别低50倍和1000倍。
igm公司尚未公布imvotamab在自免适应症不及预期的具体数据,但市场猜测与igm骨架的路线有很大的关系(目前全球尚无igm分子成药)。天然的igm抗体在人体的半衰期为5.1天,在过往临床中igm抗体半衰期一般不超过两天,而imvotamab在过往的一期临床中半衰期更低,只有1.5天。这种短半衰期、高亲和力的tce药物,好处是能够带来比较好的治疗安全性,但缺点在于需要频繁注射降低了患者的依从性。
过往imvotamab近100名非霍奇金淋巴瘤(nhl)患者的数据显示:其展现出良好的安全性(所有剂量组的细胞因子释放综合征发生率为15%,100mg维持剂量组为9%),并在结合和杀死低cd20表达细胞方面显示出优越的效力。
另一个市场猜测疗效不及预期的点可能是在于cd3部分设计出现了一定的问题,tce双抗的疗效和安全性往往会受到空间位阻等因素的影响,另外与cd3的亲和力高或低的平衡也需要研发者进行把控(亲和力高有可能带不来肿瘤杀伤力的增强,低可能则有脱靶带来的安全性风险)。
igm公司在imvotamab的失利,充分说明了tce双抗自免领域并非像“大量bd井喷”一样那么吃得开,特别是前有单抗、后有car-t的竞争下,tce双抗需要在疗效突出的同时规避潜在的安全性风险,这实属不易。
02
肿瘤转型过来的自免tce管线,压力山大?
igm之后,压力给到剩下“肿瘤转自免的tce双抗”领军者。
目前全球范围内,除了igm公司之外进度最快的是cullinan therapeutics,同样该公司在2024年4月之前才叫cullinan oncology,显然是一家专注于肿瘤药物开发的公司,由于部分管线拓展自免适应症,故而更名。
cullinan拓展自免领域的核心资产是cln-978,这是一款cd3/cd19双抗,同时也是首个fda批准自免适应症ind的cd19 t细胞衔接器疗法。
cln-978由cd19和cd3的单链可变片段组成,同时包含一个白蛋白结合域以延长半衰期,该药物特点在于其经工程改造对cd19有很高的结合亲和力(即便是cd19表达量极低的b细胞、临床前显示优于安进的贝林妥欧单抗)、对cd3具有更低的亲和力(降低安全性风险)及可实现皮下注射(注射便捷性)。
目前cln-978在自免领域刚进入临床阶段,成为首个fda批准自免适应症ind的cd19 t细胞衔接器。临床前数据显示,cln-978的皮下给药在骨髓、脾脏和淋巴组织中实现了快速、深度和持续的b细胞耗竭,同时减轻了细胞因子释放。
值得注意的是,公司cln-978首个临床探索的适应症为弥漫性大b细胞淋巴瘤(dlbcl),一期小样本数据显示:3名患者每周接受30mg皮下注射,在首次给药后96小时内2名具有可检测基线b细胞的患者外周b细胞分别减少了93%和98%,而两名肿瘤体积较大的患者在首次给药后出现了一级crs事件,其他不良事件为低级别或于机制相关事件(如淋巴细胞减少症)。
cln-978的一期sle临床将在2025q4获得初步数据,这或许是目前海外tce双抗治疗自免疾病读出最快的早期临床数据之一,值得期待。
03
国产从肿瘤转型自免的管线待验证
当然,我们也没有必要过分担心肿瘤转自免这些“tce双抗”的风险。过往并非没有这样“转向”的药物成功案例,比如罗氏的cd20利妥昔单抗从血液瘤拓展至类风湿性关节炎(ra)等自免疾病,商业化天花板获得了极大的突破。
相对于单抗,目前tce双抗对于自免疾病有着更为合理技术理论优势,亟待验证;不过,不同的是,相对于肿瘤适应症,自免患者由于靶细胞负荷较低,需要的药物剂量也比肿瘤患者更低,这无疑会降低相关crs和icans的风险。同时,tce双抗需要保证目标靶点的亲和力以提供更持久、更彻底的b细胞耗竭,同时极力提升药物安全性(自免患者对副作用更敏感)。
比较经典的可能是和默沙东达成合作的同润生物cd19/cd3双抗cn-201,该药物通过药明生物wuxibody平台构建,tcr替代ch1和cl,避免轻链错配,根据需要可以采取1:1或2:1价态设计;该分子为低亲和力cd3抗体,可快速结合快速解离,同时可以保持强效且深度的b细胞清除能力,有效性和安全性初步数据均不错。
从cn-201最新披露的治疗r/r b-all患者的一期数据显示,51例患者中有16例患者接受20mg及以上目标剂量的治疗,12/16(75%)例患者达到cr/cri;7例患者接受40mg及以上目标剂量的治疗,6/7(85.7%)例患者达到cr/cri,缓解持续时间最长的为8个月。另外试验中有15例患者发生crs,其中2例为3级事件,主要发生在首次给药后,其他大多数为低级别,未观察到免疫效应细胞相关神经毒性综合征(icans)。可以看到,cn-201在r/r b-all这样治疗疗效差的恶性血液肿瘤保持了较强的疗效,且在高剂量下安全性相对可控,也让人期待其低剂量下对自免适应症的疗效和安全性。
另一值得关注的是康诺亚的bcma/cd3双抗cm336,其在去年以newco的形式出海且对应项目公司ouro medicines近日获得了一笔大额的融资。
cm336是康诺亚开发的弱化设计的天然y型抗体,临床前数据显示:cm336在bcma靶点亲和力上显著由于强生的bcma/cd3双抗teclistamab,同时cm336较同类竞品tdcc活性更强以及细胞因子释放效应更弱。
cm336最新的临床数据一定程度反馈了其临床前数据所展现的优势,复发或难治性多发性骨髓瘤68例患者(4线)参与了cm336的i/ii期研究,在剂量递增和扩展阶段cm336的orr分别为67%和76%,其中80mg和160mg剂量组的orr为100%;在剂量递增阶段的中位随访时间达12.1个月时,52%的受试者实现了严格意义上的完全缓解(scr)或完全缓解(cr)。安全性方面,cm336剂量成功递增至160 mg,且尚未达到最大耐受剂量。大多数crs为1级事件,仅7%受试者发生2级crs事件,未发生免疫效应细胞相关神经毒性综合征。
从cm336一期临床如此高剂量爬坡和较低的安全性风险,我们有理由期待一下其在自免适应症中的发挥。
https://mp.weixin.qq.com/
责编: editor相关news
- 诺华将两款眼科药物在中国的独家进口、商业推广和分销权转让给康哲药业 2025-11-02
- 2025-11-02
- 昂利康:注射用alk-n001/qhl-1618于2025年4月获得药物临床试验批准通知书 2025-11-01
- 全球首个 乐普生物egfr adc新药mrg003获批上市 2025-11-01
- 智飞生物交出十年来最差三季报 2025-10-31