国产adc的机会时刻
2025-05-20
来源: drugdu
 204
204
近日,礼来宣布其nectin-4靶向adc药物ly4052031因安全性问题暂停临床试验。
nectin-4是adc药物开发的一个热门靶点,目前全球仅一款nectin-4靶向adc产品被批准上市,即padcev,获批用于治疗尿路上皮癌。礼来曾布局两款下一代抗nectin-4 adc药物:ly4052031(毒素为dna拓扑酶i抑制剂camp98)和ly4101174(毒素为exatecan)。此次暂停涉及ly4052031,而ly4101174仍然在进行临床i期试验,人体药效及毒性反应有待观察。
此次事件也引发行业对nectin-4 adc安全性的关注,并将adc药物的研发难点暴露无遗:载荷毒性控制、连接子稳定性,任何一个环节的“短板”都可能引发连锁反应。
1.中国biotech迎来机会
nectin-4是一种免疫球蛋白样抗原,正常组织仅表达低至中等水平的nectin-4,但在多种癌症中过表达,包括尿路上皮癌、乳腺癌、卵巢癌、非小细胞肺癌和胃癌等。同时,在回顾性研究中,nectin-4的高表达与较差的预后有关,这也意味着它可以用作改善患者预后。这使得该蛋白成为癌症治疗的一个有吸引力的靶点。
目前,全球仅一款nectin-4 adc获批上市,即安斯泰来和辉瑞的enfortumab vedotin(维恩妥尤单抗padcev)。该药于2019年在美国首次获批,用于二线治疗晚期尿路上皮癌;2023年又获批与keytruda的联合用于一线治疗局部晚期或转移性尿路上皮癌患者。
padcev销售额在2023年就突破了10亿美元,2024年销售额达到15.88亿美金,同比增长超过50%。根据nature reviews的预测,到2026年,padcev的销售额有望达到35亿美元。
padcev在尿路上皮癌上的成功证明了nectin-4靶点adc的临床应用价值。
但padcev来自seagen的第二代抗体偶联技术,存在偶联比的不均一等限制,这会带来药物的异质性。其说明书上带有可导致重度和致死性皮肤不良反应的黑框警告,包括stevens-johnson综合征(sjs)和中毒性表皮坏死松解症(ten),该类皮肤不良反应主要发生在治疗的第一周期,但也可能较晚发生。此外padcev在除尿路上皮癌的其它癌种上疗效有限,限制了其临床适应症的应用范围。
因此,各企业试图从毒素、连接子方面进行优化,开发新一代nectin-4 adc药物,并拓展其临床应用范围。
其中,迈威生物的9mw2821进展最快,已进入临床ⅲ期。
9mw2821应用了其adc开发平台的含药连接子及定点偶联技术两项全球专利,采用半胱氨酸桥定点偶联,形成dar值均一为4的adc药物,同时使用定点连接子接头idconnect替换了马来酰亚胺(mc),使得稳定性更好。相对padcev,9mw2821在nectin-4靶向治疗常见的皮肤毒性,眼毒性以及周围神经病变均有较大的改善。
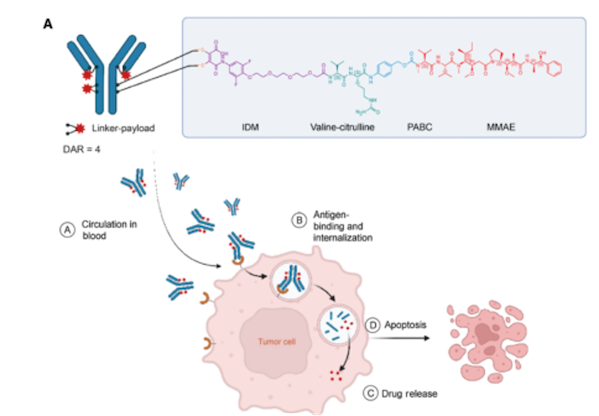
目前,9mw2821针对尿路上皮癌(uc)、三阴性乳腺癌(tnbc)、食管癌(ec)、宫颈癌(cc)等多个适应症显示出优异的有效性和良好的安全性。
就padcev主攻的尿路上皮癌,9mw2821单药二线治疗客观缓解率(orr)和疾病控制率(dcr)分别为62.2%和91.9%,优于padcev的41%和71.9%。
而9mw2821联用pd-1单抗一线治疗尿路上皮癌患者也已进入iii期临床阶段。数据显示,该联合疗法客观缓解率(orr)为87.5%,经确认的orr为80%,疾病控制率(dcr)为92.5%,数据优异。
安全性方面,在2024年asco上公布的近260例使用9mw2821治疗的患者数据中,其安全性整体可控。最常见的不良反应为白细胞和中性粒细胞的减少(接近50%患者),其中25%的患者出现3-4级的不良反应,但可通过g-csf得到有效控制。
目前,9mw2821的uc、cc适应症已进入临床ⅲ期,ec和tnbc适应症也已进入临床ⅱ期,且已获fda授予快速通道认定(宫颈癌、食管鳞癌、三阴性乳腺癌)、孤儿药资格认定(食管癌);被nmpa cde纳入突破性治疗品种名单(尿路上皮癌)。太平洋证券预计其未来国内多个适应症合计峰值销售有望达35亿元。
此外,目前国内针对多个瘤种(如乳腺癌、宫颈癌、食管癌)研发的adc药物,多采用喜树碱类毒素。随着同类药物广泛应用,未来耐药性问题或将凸显。而9mw2821采用mmae作为有效载荷,在这些适应症上展现出差异化竞争优势,为其切入topi经治领域创造了契机。例如,迈威生物正在重点推进topi经治tnbc适应症的ii期临床试验。
2.平台优势尽显
9mw2821的成功源于迈威生物开发的新一代adc定点偶联技术平台(iddc™平台)及新型载荷mtoxin™。
迈威生物曾在第14届世界抗体药物偶联大会(world adc london)展示该平台及该平台赋能下多款adc药物的开发情况。
iddc™由多项系统化核心专利技术组成:
1.定点偶联工艺darfinity™:产生dar 4为主成分的定点偶联药物(dar 4≧95%)。
2.定点连接子接头idconnect™:是一种新型的定点偶联接头,该设计自水解结构,能够有效抑制药物代谢过程中的巯醚交换作用,从而提升adc药物血浆稳定性,提高载荷传递效率(相对对照组提升40%)。
3.条件释放结构lysonly™:是一款新型的仅依赖赖氨酸酶释放的连接子结构,可提升adc药物的肿瘤特异性释放能力,降低脱靶效应。
4.新型载荷mtoxin™(mf6):是迈威生物开发的一种喜树碱衍生物,该分子相对已知喜树碱分子dxd、sn38具有更强的肿瘤抑制作用、更好的旁观者杀伤作用,而且在dxd耐药的多药耐药模型中保持显著疗效。
迈威生物的创新分布在adc的各个环节,尤其是其新型载荷mf6,已在7mw3711、9mw2921、7mw4911这三个管线品种中得到应用:
7mw3711(b7-h3 adc)
b7-h3是近几年adc研发领域的热门靶点,其在非小细胞肺癌、胰腺癌、原发性肝癌等多种肿瘤组织中都存在过度表达。此前翰森制药就hs-20093与gsk达成超17亿美元的独家许可协议,成功“出海”,引发了行业对这一靶点的关注。
目前全球尚无b7-h3 adc上市。迈威生物的b7-h3 adc(7mw3711)处于i/ii期临床试验阶段。7mw3711与pd-1抑制剂的联用方案也在今年获得nmpa批准开展用于晚期实体瘤患者的ib/ii期临床试验。该药于2024年7月获美国fda授予孤儿药资格认定,用于治疗小细胞肺癌。
在今年aacr年会上,迈威生物展示了7mw3711与parp抑制剂联用的临床前研究成果。7mw3711单药治疗晚期实体瘤及肺癌的i/ii期临床研究数据均将在今年的asco大会上公布。
9mw2921(trop2 adc)
trop2是adc药物开发的成熟靶点。迈威生物的9mw2921相较国内外同类型在研adc品种,在内吞活性,血浆稳定性,药物释放特性,旁观者杀伤效应等方面均得到显著改善与提升。目前处于i/ii期临床试验阶段。今年asco大会上也将首次公布其针对晚期实体瘤患者的首个人体临床研究数据。
7mw4911(cdh17 adc)
cdh17也是当红抗肿瘤研究靶点,在50%-90%的胃肠道癌症中过表达且重新分布,导致其暴露于癌细胞表面,因此变得更容易被抗体药物靶向,成为治疗胃肠道肿瘤的潜在理想adc靶点。
不过,目前cdh17 adc药物研发大多尚处于临床前开发或早期临床阶段,进展最快的也才处于临床i期爬坡阶段。迈威生物的cdh17 adc(7mw4911)临床前研究显示,在多种消化道肿瘤的cdx/pdx模型中表现出显著的抗肿瘤活性,在crc pdx模型中,在1-3 mg/kg给药时观察到显著的抗肿瘤活性;在胃癌cdx模型中,3mg/kg显示出显著的抗肿瘤活性。且不受(pgp)耐药机制干扰,在多药耐药消化道肿瘤模型上有显著效果。另外,毒理学研究显示安全性良好。迈威生物计划在今年下半年实现中美ind双报。
尽管已在adc技术方面进行了多领域的创新,但迈威生物企图不止于此。
近期,迈威生物相继与英矽智能、深势科技达成合作,布局ai,赋能早期靶点发现与评估、adc新型毒素开发、大分子成药性优化等各环节,全面加速adc药物创新研发进程。
3.结语
在adc研发浪潮中,虽然参与者众多,但真正能够成功开发出安全、有效的adc药物,并推向市场的企业仍是凤毛麟角,目前全球仅有18款adc药物获批上市。adc作为精准医疗时代的一颗璀璨明星,其设计理念虽看似直观——将高效细胞毒性药物通过特异性抗体精准递送至肿瘤细胞,实现“精准打击”,但实际操作中,每一个环节——抗体、连接子、毒素都需要精心设计,才能真正发挥它的巨大潜力。
作为一家创新型生物制药公司,研发创新是核心驱动力,也是未来所在。持续的技术创新、临床导向的适应症选择,迈威生物正不断构建在adc赛道的独特优势。未来,随着ai技术的赋能,迈威生物有望在adc新靶点、新毒素开发及adc新技术平台开发上更上一层楼,成为adc领域的创新领航者。
https://news.yaozh.com/archive/45471.html
责编: editor相关news
- 诺华将两款眼科药物在中国的独家进口、商业推广和分销权转让给康哲药业 2025-11-02
- 2025-11-02
- 昂利康:注射用alk-n001/qhl-1618于2025年4月获得药物临床试验批准通知书 2025-11-01
- 全球首个 乐普生物egfr adc新药mrg003获批上市 2025-11-01
- 智飞生物交出十年来最差三季报 2025-10-31