小核酸疗法叫板glp-1巨头
2025-07-10
来源: drugdu
 161
161
rnai技术通过精准调控肥胖相关基因表达,直指glp-1药物核心短板。凭借“减脂不掉肌”的颠覆性优势,rnai疗法正强势叫板glp-1千亿市场“霸权”!
01小核酸疗法浪潮已至
小核酸疗法,尤其是sirna(小干扰rna)技术,凭借其独特的基因沉默机制与持续革新的递送技术,共同推动治疗领域从罕见病向慢性病拓展,引领生物医药领域的第三次创新浪潮。
从技术原理看,sirna通过rna干扰(rnai)机制实现精准基因沉默。其双链结构中,引导链(反义链)被装载至risc复合物后特异性结合靶mrna并引导降解,从而阻断致病蛋白表达;而客链(正义链)则发挥保护性递送功能。尤为关键的是,risc复合物可循环利用,单个sirna分子能持续切割多个mrna靶标,赋予药物长效作用特性(图1)。这一机制突破传统药物局限,使以往“不可成药”的靶点成为可能,显著拓宽适应症范围。
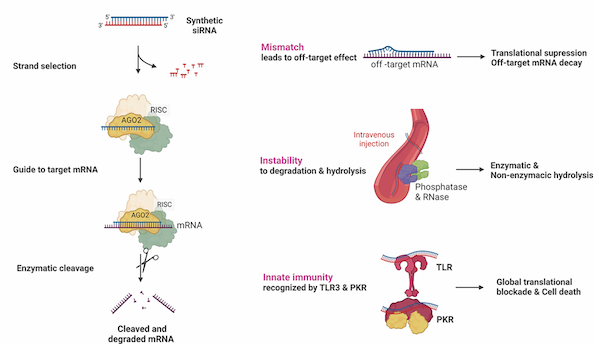 图1 sirna的作用机制和特点
图1 sirna的作用机制和特点
图片来源:参考资料[1]
产业发展进程印证了sirna技术突破的转化效率。2018年全球首款sirna药物patisiran获批,标志着rnai疗法正式落地;2019年galnac偶联递送技术药物givosiran上市,则通过高效肝靶向性和缓释特性,系统性解决早期sirna的稳定性和毒性问题;2020年降胆固醇药物inclisiran获欧盟批准,更将适应症从罕见病延伸至心血管慢性病领域,开辟全新市场空间。
迄今为止,全球已有7款sirna药物获fda批准上市,除首款药物使用lnp作为递送系统外,其余6款均采用galnac递送系统,充分验证该技术平台的临床优势,其皮下注射给药方式兼具长效性与安全性,肝脏靶向效率超过90%,为肝源性疾病提供变革性治疗方案。
此外,市场增长数据进一步佐证小核酸药物产业爆发趋势。据evaluate pharma统计,全球sirna药物市场规模已突破50亿美元,预计2030年将达到200亿美元。这一增长动能不仅源于现有肝靶向药物的成功,更得益于技术迭代带来的治疗疆域扩张。随着新型递送系统开发,sirna疗法正突破肝脏局限,向肾脏、中枢神经系统及肿瘤等多器官疾病拓展,为产业持续注入发展潜力。
02锁定肥胖“黄金靶点”
近年来,基于大规模人类遗传学研究,科学家成功锁定多个经遗传验证的肥胖治疗“黄金靶点”,为开发新一代减重疗法提供了全新方向。
gpr75的致病性突变是降低肥胖风险的重要遗传因素。2021年science期刊上发表的一项覆盖64.5万人的外显子组测序研究揭示(图2):携带gpr75功能缺失突变的个体(约1/3000)平均体重减轻5.3公斤,肥胖风险降低54%。机制研究表明,gpr75在下丘脑食欲调节神经元中高表达,调控能量摄入平衡。动物实验进一步证实,敲除gpr75基因的小鼠在高脂饮食下体重增长率降低44%,且葡萄糖耐量和胰岛素敏感性显著改善。
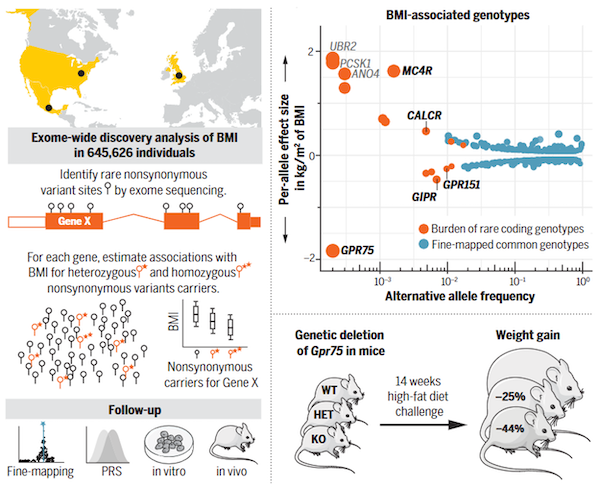 图2基于外显子组测序的bmi相关基因发现
图2基于外显子组测序的bmi相关基因发现
无独有偶,2022年在nature communications上发布的一项遗传学研究发现,inhbe功能缺失突变携带者呈现低腰臀比(即腹部脂肪减少)、低甘油三酯和高密度脂蛋白升高等代谢改善特征。
inhbe和alk7同属tgfβ超家族,构成肝脏与脂肪组织间的代谢调控轴。inhbe在肝脏中表达,其产物激活素e(activin e)分泌入血后,结合脂肪细胞表面的alk7受体,激活smad2/3信号通路,进而抑制脂肪分解、促进脂质储存并诱导胰岛素抵抗(图3)。
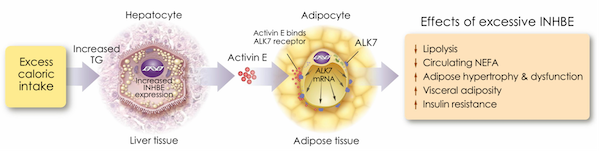 图3由inhbe基因编码的肝激活素e调节脂肪组织的能量稳态
图3由inhbe基因编码的肝激活素e调节脂肪组织的能量稳态
另外,脂蛋白脂肪酶(lpl)对于甘油三酯(tg)代谢和脂肪分布具有重要作用,angptl3/4/8通过精细调控lpl活性,决定tg的存储与利用。其中angptl3在肝脏持续表达,抑制lpl活性,升高血浆vldl水平,促进动脉粥样硬化。
机制研究表明:禁食时angptl4上调,抑制白色脂肪组织(wat)中lpl,促使tg被心脏和肌肉利用;进食时angptl8上调,与angptl3形成复合物抑制肌肉lpl,驱动tg向wat储存。因此,angptls亦成为国内外企业争相布局的新一代降脂药物潜在靶点。
03动了glp-1的蛋糕
小核酸药物正以颠覆性姿态切入千亿减重市场,直指当前glp-1受体激动剂的临床缺陷与市场空白。2024年司美格鲁肽全球销售额高达292.96亿美元,替尔泊肽增速近220%,印证glp-1类药物的统治地位。然而其痛点显著,停药后体重反弹率超80%,且减重同时伴随约25%-40%肌肉流失,导致代谢率下降和虚弱风险。
针对这些短板,以rnai为核心的小核酸药物通过全新机制破局。数据显示,目前全球20款小核酸减重管线中,6款已进入i期及以上临床阶段,另有14款处于临床前研究阶段(图4)。
在众多靶点中,inhbe被视作减脂的潜在“黄金靶点”,沉默inhbe可激活脂肪分解通路。临床前数据显示,inhbe-sirna单药减重效果媲美司美格鲁肽,同时肌肉保留率提升超90%。arrowhead的aro-inhbe在食蟹猴模型中单次给药实现靶点敲低持续85天以上,脂肪量显著下降。
此外,长效性是小核酸药物的另一显著优势。例如,alnylam基于gemini平台支持3-6个月皮下注射一次,wave的wve-007给药频次仅为1-2次,这突破了glp-1需每周注射带来的依从性瓶颈。
尤为关键的是,小核酸药物与glp-1显示出协同增效潜力,二者联用可形成“减脂-抑食”双通路。wave实验表明,其inhbe sirna联合司美格鲁肽使小鼠减重效果翻倍,并在glp-1停药后阻遏了83%的体重反弹。arrowhead更将alk7 sirna与替尔泊肽的联用方案直接纳入i/iia期临床试验设计。
在激烈的研发竞速中,技术平台已成为决胜关键。arrowhead凭借trim递送系统实现脂肪组织靶向,同时推进aro-inhbe和aro-alk7双管线;wave利用galnac偶联技术使wve-007于2025年启动inlight i期试验,预计年内公布人体数据;alnylam则借力gemini多靶点平台布局inhbe组合疗法。
04结语
尽管小核酸药物来势汹汹,但随着入局者持续增加,行业竞争门槛正快速提升,吃到这块蛋糕的难度正不断升级。小核酸企业需在递送效率和成本控制上持续突破,方能在千亿市场中分羹。
责编: editor相关news
- 诺华将两款眼科药物在中国的独家进口、商业推广和分销权转让给康哲药业 2025-11-02
- 2025-11-02
- 昂利康:注射用alk-n001/qhl-1618于2025年4月获得药物临床试验批准通知书 2025-11-01
- 全球首个 乐普生物egfr adc新药mrg003获批上市 2025-11-01
- 智飞生物交出十年来最差三季报 2025-10-31